TD10 Corrigé
DownloadTélécharger
Actions
Vote :
ScreenshotAperçu
Informations
Catégorie :Category: mViewer GX Creator Lua TI-Nspire
Auteur Author: Pa Baz
Type : Classeur 3.6
Page(s) : 11
Taille Size: 953.80 Ko KB
Mis en ligne Uploaded: 07/04/2015 - 00:52:10
Uploadeur Uploader: Pa Baz (Profil)
Téléchargements Downloads: 289
Visibilité Visibility: Archive publique
Shortlink : http://ti-pla.net/a184530
Type : Classeur 3.6
Page(s) : 11
Taille Size: 953.80 Ko KB
Mis en ligne Uploaded: 07/04/2015 - 00:52:10
Uploadeur Uploader: Pa Baz (Profil)
Téléchargements Downloads: 289
Visibilité Visibility: Archive publique
Shortlink : http://ti-pla.net/a184530
Description
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
TD 10
Diagrammes binaires
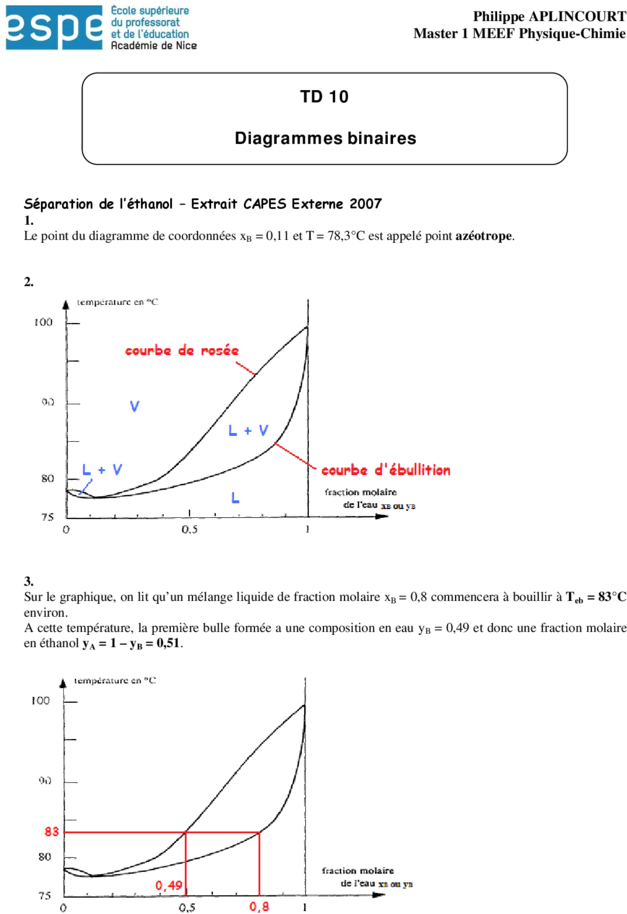
Séparation de l’éthanol – Extrait CAPES Externe 2007
1.
Le point du diagramme de coordonnées xB = 0,11 et T = 78,3°C est appelé point azéotrope.
2.
3.
Sur le graphique, on lit qu’un mélange liquide de fraction molaire xB = 0,8 commencera à bouillir à Teb = 83°C
environ.
A cette température, la première bulle formée a une composition en eau yB = 0,49 et donc une fraction molaire
en éthanol yA = 1 – yB = 0,51.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
4.
Sur le graphique, on lit qu’un mélange liquide de fraction molaire xB = 0,8 finira de bouillir à Tev = 94°C
environ.
A cette température, la dernière goutte de liquide a une composition en eau xB = 0,98 et donc une fraction
molaire en éthanol xA = 1 – xB = 0,02.
On considère une mole d’un mélange liquide de fraction molaire xB = 0,8, initialement à 20°C, que l’on chauffe
sous une pression constante de 1,013 bar.
5.a.
D’après le diagramme :
dans la phase gazeuse, les fractions sont les suivantes : yB = 0,39 yA = 0,61
dans la phase liquide, les fractions sont les suivantes : xB = 0,56 xA = 0,44
5.b.
Les quantités de matière sont données par le théorème des moments chimiques :
n l AB 0,5 0,39 0,11
1,83 et n(l) + n(v) = 1 mole
n v AC 0,56 0,5 0,6
1
1,83.n(v) + n(v) = 1 n v n(v) = 0,35 mol n(l) = 0,65 mol
2,83
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
5.c.
Sur le diagramme, on a lu que :
dans la phase gazeuse, les fractions sont les suivantes : yB = 0,39 yA = 0,61
dans la phase liquide, les fractions sont les suivantes : xB = 0,56 xA = 0,44
Les quantités d’eau et d’éthanol dans la phase gazeuse sont :
nA,V = yA.n(v) = 0,61 * 0,35 A.N. : nA,V = 0,21 mol
nB,V = yB.n(v) = 0,39 * 0,35 A.N. : nA,V = 0,14 mol
Les quantités d’eau et d’éthanol dans la phase liquide sont :
nA,L = xA.n(l) = 0,44 * 0,65 A.N. : nA,L = 0,29 mol
nB,L = xB.n(l) = 0,56 * 0,65 A.N. : nA,L = 0,36 mol
5.d.
nRT 0,35 * 8,314 * 273 80
Pour un gaz parfait : PV = nRT V
P 1,013.105
A.N. : V = 10,1.10-3 m3 = 10,1 L
6.
Il sera impossible de séparer les 2 constituants par distillation fractionnée. Le distillat aura toujours la
composition de l’azéotrope.
7.
Le mélange possède la composition de l’azéotrope. Comme dans le cas des corps purs, le changement
d’état de l’azéotrope a lieu a température constante :
.
T (°C)
V
L+V
78,3 L
t (min)
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
Equilibre liquide-solide du binaire eau-urée
1.
L’allure du diagramme binaire indique que l’urée et l’eau sont non miscibles à l’état solide.
2.
Courbe 1 : liquidus
Courbe 2 : solidus
3.
Domaine I : une phase liquide (urée et eau)
Domaine II : une phase liquide (urée et eau) et une phase solide (eau)
Domaine III : une phase liquide (urée et eau) et une phase solide (urée)
Domaine IV : deux phases solides (urée et eau)
4.
Le point A est le point eutectique. Il correspond à un système où coexistent de l’urée solide et liquide ainsi que
de l’eau solide et liquide.
5.
Le système considéré possède une fraction molaire en urée w = 0,7. Le point A caractéristique de l’état du
système est reporté sur le diagramme isobare.
La variance se calcule, à pression constante, grâce à la formule : v=n–r+2-
Si la pression est fixée, la variance réduite est égale à v’ = v – 1.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
Calculs de variance v :
n r Variance
Partie AB 2 (urée(l) ; eau(l)) 0 1 v=2–0+2–1=3
Partie BC 3 (urée(s) ; urée(l) ; eau(l)) 1 (urée(s) = urée(l)) 2 v=3–1+2–2=2
3 (urée(s) ; urée(l) ; eau(s) ; 2 (urée(s) = urée(l) ;
Partie CD 3 v=4–2+2–3=1
eau(l)) eau(s) = eau(l))
Partie DE 2 (urée(s) ; eau(s)) 0 2 v=2–0+2–2=2
6.
Le point représentatif du système à 0°C est le point M. Le théorème de l’horizontale nous permet de déterminer
la composition de la phase liquide. Celle-ci est donnée par l’abscisse du point L. La phase liquide contient donc
40 % d’urée et 60 % d’eau en masse,
Appliquons le théorème des moments pour calculer la masse d’urée et la masse d’eau de la phase liquide :
ml MS 1,0 0,7 0,3
1 soit m(l) = m(s) = 50 g
ms LM 0,7 0,4 0,3
La phase liquide contient donc :
murée = 0,4 * 50 murée = 20 g
meau = 0,6 * 50 murée = 30 g
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
7.
Entre les points M et N, c'est-à-dire pour une fraction massique globale en urée variant de 100 % à 36 %, le
mélange contient une phase solide et une phase liquide. La composition du liquide se lit au niveau de l’abscisse
du point N. La phase liquide contiendra 36 % d’urée quelque soit la fraction massique globale.
Entre les points N et O, c'est-à-dire pour une fraction massique globale en urée variant de 36 % à 16 %, le
mélange est entièrement liquide. La phase liquide contiendra donc 36 % à 16 % d’urée selon la fraction
massique globale.
Entre les points O et P, c'est-à-dire pour une fraction massique globale en urée variant de 16 % à 10 %, le
mélange contient une phase solide et une phase liquide. La composition du liquide se lit au niveau de l’abscisse
du point O. La phase liquide contiendra 16 % d’urée quelque soit la fraction massique globale.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
Mélange cuivre-argent
1.
Le diagramme isobare correspondant au mélange argent-cuivre est donné ci-dessous :
La solution solide correspond à un réseau cristallin d’atomes d’argent dans lequel sont présents des atomes de
cuivre en nombre beaucoup plus faible que ceux d’argent. Il peut s’agir d’une solution solide d’insertion ou de
substitution.
La solution solide correspond à un réseau cristallin d’atomes de cuivre dans lequel sont présents des atomes
d’argent en nombre beaucoup plus faible que ceux de cuivre.
Les coordonnées du point eutectique E sont T = 1060 K et xCu = 0,4
2.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
Calculs de variance :
n R Variance
Partie AB 2 (Cu(l) ; Ag(l)) 0 1 v=2–0+2–1=3
Partie BC 3 ( ; Ag(l) ; Cu(l)) 1 ( = Ag(l) + Cu(l)) 2 v=3–1+2–2=2
2 ( = Ag(l) + Cu(l) ;
Partie CD 4 ( ; ; Ag(l) ; Cu(l)) 3 v=4–2+2–3=1
= Ag(l) + Cu(l))
Partie DE 2 ( ; ) 0 2 v=2–0+2–2=2
3.
A 1100 K, on est en présence :
d’une phase liquide contenant 30 % de cuivre
d’une solution solide contenant 10 % de cuivre
4.
On peut purifier le barreau d’argent en utilisant la méthode de la zone fondue.
On procède au chauffage d’une des extrémités du barreau à l’aide d’une bobine pour créer une zone fondue
(pour un barreau d’argent contenant 10 % de cuivre, T > 1180 K environ). En refroidissant légèrement, le
liquide s’enrichi en cuivre et le solide cristallisé s’appauvrit en cuivre, devenant ainsi de plus en plus pur.
Cette zone est déplacée le long du barreau et entraîne successivement les impuretés à l’autre extrémité du
barreau.
Pour atteindre une grande pureté, il sera nécessaire d’opérer plusieurs passages.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
L’alliage aluminium/hafnium
1. 2.
Ce diagramme met en évidence trois composés définis.
3
x Al 0,6 composé Al3Hf2
5
2
x Al composé Al2Hf
3
3
x Al composé Al3Hf
4
3.
Il s’agit d’un point eutectique. En ce point, le mélange liquide a la même composition que les phases solides
dont il est issu.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
4.
x = 0,60 :
Calculs de variance v (on suppose ici que la pression n’est pas un facteur d’équilibre car on est en présence de
phases condensées) :
n r, k Variance
Partie AB 2 (Al(l) ; Hf(l)) 0 1 v=2–0+1–1=2
1 (Al3Hf2(s) = 3 Al(l) + 2 Hf(l))
Point B 3 (Al3Hf2(s) ; Al(l) ; Hf(l)) 2 v=3–2+1–2=0
xAl = 1,5.xHf
Partie BC 1 (Al3Hf2(s)) 0 1 v=1–0+1–1=1
x = 0,62 :
Calculs de variance v (on suppose ici que la pression n’est pas un facteur d’équilibre car on est en présence de
phases condensées) :
n r, k Variance
Partie AB 2 (Al(l) ; Hf(l)) 0 1 v=2–0+1–1=2
4 (Al3Hf2(s) ; Al2Hf(s) ; Al(l) ; 2 (Al3Hf2(s) = 3 Al(l) + 2 Hf(l) ;
Point B 3 v=4–2+1–3=0
Hf(l)) Al2Hf(s) = 2 Al(l) + Hf(l)
Partie BC 2 (Al3Hf2(s) ; Al2Hf(s)) 0 2 v=2–0+1–2=1
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
x = 0,69 :
Calculs de variance v (on suppose ici que la pression n’est pas un facteur d’équilibre car on est en présence de
phases condensées) :
n r, k Variance
Partie AB 2 (Al(l) ; Hf(l)) 0 1 v=2–0+1–1=2
Partie BC 3 (Al3Hf(s) ; Al(l) ; Hf(l)) 1 (Al3Hf(s) = 3 Al(l) + Hf(l)) 2 v=3–1+1–2=1
4 (Al3Hf(s) ; Al2Hf(s) ; Al(l) ; 2 (Al3Hf(s) = 3 Al(l) + Hf(l) ;
Point C 3 v=4–2+1–3=0
Hf(l)) Al2Hf(s) = 2 Al(l) + Hf(l)
Partie CD 2 (Al3Hf(s) ; Al2Hf(s)) 0 2 v=2–0+1–2=1
Master 1 MEEF Physique-Chimie
TD 10
Diagrammes binaires
Séparation de l’éthanol – Extrait CAPES Externe 2007
1.
Le point du diagramme de coordonnées xB = 0,11 et T = 78,3°C est appelé point azéotrope.
2.
3.
Sur le graphique, on lit qu’un mélange liquide de fraction molaire xB = 0,8 commencera à bouillir à Teb = 83°C
environ.
A cette température, la première bulle formée a une composition en eau yB = 0,49 et donc une fraction molaire
en éthanol yA = 1 – yB = 0,51.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
4.
Sur le graphique, on lit qu’un mélange liquide de fraction molaire xB = 0,8 finira de bouillir à Tev = 94°C
environ.
A cette température, la dernière goutte de liquide a une composition en eau xB = 0,98 et donc une fraction
molaire en éthanol xA = 1 – xB = 0,02.
On considère une mole d’un mélange liquide de fraction molaire xB = 0,8, initialement à 20°C, que l’on chauffe
sous une pression constante de 1,013 bar.
5.a.
D’après le diagramme :
dans la phase gazeuse, les fractions sont les suivantes : yB = 0,39 yA = 0,61
dans la phase liquide, les fractions sont les suivantes : xB = 0,56 xA = 0,44
5.b.
Les quantités de matière sont données par le théorème des moments chimiques :
n l AB 0,5 0,39 0,11
1,83 et n(l) + n(v) = 1 mole
n v AC 0,56 0,5 0,6
1
1,83.n(v) + n(v) = 1 n v n(v) = 0,35 mol n(l) = 0,65 mol
2,83
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
5.c.
Sur le diagramme, on a lu que :
dans la phase gazeuse, les fractions sont les suivantes : yB = 0,39 yA = 0,61
dans la phase liquide, les fractions sont les suivantes : xB = 0,56 xA = 0,44
Les quantités d’eau et d’éthanol dans la phase gazeuse sont :
nA,V = yA.n(v) = 0,61 * 0,35 A.N. : nA,V = 0,21 mol
nB,V = yB.n(v) = 0,39 * 0,35 A.N. : nA,V = 0,14 mol
Les quantités d’eau et d’éthanol dans la phase liquide sont :
nA,L = xA.n(l) = 0,44 * 0,65 A.N. : nA,L = 0,29 mol
nB,L = xB.n(l) = 0,56 * 0,65 A.N. : nA,L = 0,36 mol
5.d.
nRT 0,35 * 8,314 * 273 80
Pour un gaz parfait : PV = nRT V
P 1,013.105
A.N. : V = 10,1.10-3 m3 = 10,1 L
6.
Il sera impossible de séparer les 2 constituants par distillation fractionnée. Le distillat aura toujours la
composition de l’azéotrope.
7.
Le mélange possède la composition de l’azéotrope. Comme dans le cas des corps purs, le changement
d’état de l’azéotrope a lieu a température constante :
.
T (°C)
V
L+V
78,3 L
t (min)
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
Equilibre liquide-solide du binaire eau-urée
1.
L’allure du diagramme binaire indique que l’urée et l’eau sont non miscibles à l’état solide.
2.
Courbe 1 : liquidus
Courbe 2 : solidus
3.
Domaine I : une phase liquide (urée et eau)
Domaine II : une phase liquide (urée et eau) et une phase solide (eau)
Domaine III : une phase liquide (urée et eau) et une phase solide (urée)
Domaine IV : deux phases solides (urée et eau)
4.
Le point A est le point eutectique. Il correspond à un système où coexistent de l’urée solide et liquide ainsi que
de l’eau solide et liquide.
5.
Le système considéré possède une fraction molaire en urée w = 0,7. Le point A caractéristique de l’état du
système est reporté sur le diagramme isobare.
La variance se calcule, à pression constante, grâce à la formule : v=n–r+2-
Si la pression est fixée, la variance réduite est égale à v’ = v – 1.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
Calculs de variance v :
n r Variance
Partie AB 2 (urée(l) ; eau(l)) 0 1 v=2–0+2–1=3
Partie BC 3 (urée(s) ; urée(l) ; eau(l)) 1 (urée(s) = urée(l)) 2 v=3–1+2–2=2
3 (urée(s) ; urée(l) ; eau(s) ; 2 (urée(s) = urée(l) ;
Partie CD 3 v=4–2+2–3=1
eau(l)) eau(s) = eau(l))
Partie DE 2 (urée(s) ; eau(s)) 0 2 v=2–0+2–2=2
6.
Le point représentatif du système à 0°C est le point M. Le théorème de l’horizontale nous permet de déterminer
la composition de la phase liquide. Celle-ci est donnée par l’abscisse du point L. La phase liquide contient donc
40 % d’urée et 60 % d’eau en masse,
Appliquons le théorème des moments pour calculer la masse d’urée et la masse d’eau de la phase liquide :
ml MS 1,0 0,7 0,3
1 soit m(l) = m(s) = 50 g
ms LM 0,7 0,4 0,3
La phase liquide contient donc :
murée = 0,4 * 50 murée = 20 g
meau = 0,6 * 50 murée = 30 g
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
7.
Entre les points M et N, c'est-à-dire pour une fraction massique globale en urée variant de 100 % à 36 %, le
mélange contient une phase solide et une phase liquide. La composition du liquide se lit au niveau de l’abscisse
du point N. La phase liquide contiendra 36 % d’urée quelque soit la fraction massique globale.
Entre les points N et O, c'est-à-dire pour une fraction massique globale en urée variant de 36 % à 16 %, le
mélange est entièrement liquide. La phase liquide contiendra donc 36 % à 16 % d’urée selon la fraction
massique globale.
Entre les points O et P, c'est-à-dire pour une fraction massique globale en urée variant de 16 % à 10 %, le
mélange contient une phase solide et une phase liquide. La composition du liquide se lit au niveau de l’abscisse
du point O. La phase liquide contiendra 16 % d’urée quelque soit la fraction massique globale.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
Mélange cuivre-argent
1.
Le diagramme isobare correspondant au mélange argent-cuivre est donné ci-dessous :
La solution solide correspond à un réseau cristallin d’atomes d’argent dans lequel sont présents des atomes de
cuivre en nombre beaucoup plus faible que ceux d’argent. Il peut s’agir d’une solution solide d’insertion ou de
substitution.
La solution solide correspond à un réseau cristallin d’atomes de cuivre dans lequel sont présents des atomes
d’argent en nombre beaucoup plus faible que ceux de cuivre.
Les coordonnées du point eutectique E sont T = 1060 K et xCu = 0,4
2.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
Calculs de variance :
n R Variance
Partie AB 2 (Cu(l) ; Ag(l)) 0 1 v=2–0+2–1=3
Partie BC 3 ( ; Ag(l) ; Cu(l)) 1 ( = Ag(l) + Cu(l)) 2 v=3–1+2–2=2
2 ( = Ag(l) + Cu(l) ;
Partie CD 4 ( ; ; Ag(l) ; Cu(l)) 3 v=4–2+2–3=1
= Ag(l) + Cu(l))
Partie DE 2 ( ; ) 0 2 v=2–0+2–2=2
3.
A 1100 K, on est en présence :
d’une phase liquide contenant 30 % de cuivre
d’une solution solide contenant 10 % de cuivre
4.
On peut purifier le barreau d’argent en utilisant la méthode de la zone fondue.
On procède au chauffage d’une des extrémités du barreau à l’aide d’une bobine pour créer une zone fondue
(pour un barreau d’argent contenant 10 % de cuivre, T > 1180 K environ). En refroidissant légèrement, le
liquide s’enrichi en cuivre et le solide cristallisé s’appauvrit en cuivre, devenant ainsi de plus en plus pur.
Cette zone est déplacée le long du barreau et entraîne successivement les impuretés à l’autre extrémité du
barreau.
Pour atteindre une grande pureté, il sera nécessaire d’opérer plusieurs passages.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
L’alliage aluminium/hafnium
1. 2.
Ce diagramme met en évidence trois composés définis.
3
x Al 0,6 composé Al3Hf2
5
2
x Al composé Al2Hf
3
3
x Al composé Al3Hf
4
3.
Il s’agit d’un point eutectique. En ce point, le mélange liquide a la même composition que les phases solides
dont il est issu.
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
4.
x = 0,60 :
Calculs de variance v (on suppose ici que la pression n’est pas un facteur d’équilibre car on est en présence de
phases condensées) :
n r, k Variance
Partie AB 2 (Al(l) ; Hf(l)) 0 1 v=2–0+1–1=2
1 (Al3Hf2(s) = 3 Al(l) + 2 Hf(l))
Point B 3 (Al3Hf2(s) ; Al(l) ; Hf(l)) 2 v=3–2+1–2=0
xAl = 1,5.xHf
Partie BC 1 (Al3Hf2(s)) 0 1 v=1–0+1–1=1
x = 0,62 :
Calculs de variance v (on suppose ici que la pression n’est pas un facteur d’équilibre car on est en présence de
phases condensées) :
n r, k Variance
Partie AB 2 (Al(l) ; Hf(l)) 0 1 v=2–0+1–1=2
4 (Al3Hf2(s) ; Al2Hf(s) ; Al(l) ; 2 (Al3Hf2(s) = 3 Al(l) + 2 Hf(l) ;
Point B 3 v=4–2+1–3=0
Hf(l)) Al2Hf(s) = 2 Al(l) + Hf(l)
Partie BC 2 (Al3Hf2(s) ; Al2Hf(s)) 0 2 v=2–0+1–2=1
Philippe APLINCOURT
Master 1 MEEF Physique-Chimie
x = 0,69 :
Calculs de variance v (on suppose ici que la pression n’est pas un facteur d’équilibre car on est en présence de
phases condensées) :
n r, k Variance
Partie AB 2 (Al(l) ; Hf(l)) 0 1 v=2–0+1–1=2
Partie BC 3 (Al3Hf(s) ; Al(l) ; Hf(l)) 1 (Al3Hf(s) = 3 Al(l) + Hf(l)) 2 v=3–1+1–2=1
4 (Al3Hf(s) ; Al2Hf(s) ; Al(l) ; 2 (Al3Hf(s) = 3 Al(l) + Hf(l) ;
Point C 3 v=4–2+1–3=0
Hf(l)) Al2Hf(s) = 2 Al(l) + Hf(l)
Partie CD 2 (Al3Hf(s) ; Al2Hf(s)) 0 2 v=2–0+1–2=1













